中西医结合学院杨晓东/郑月娟团队新发现:WSB1/2靶向甲基化的RelA促进其降解和NF-κB转录终止
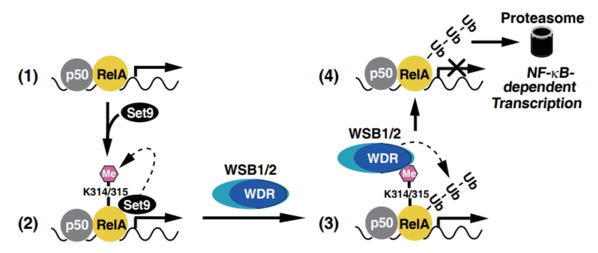
炎症是免疫系统应对感染或损伤而发起的一种保护性反应,但过度的炎症反应会导致各种炎症疾病。炎症反应的启动依赖于基因的快速转录,NF-κB是驱动炎症相关基因转录的核心转录因子。持续的NF-κB激活会造成危害,已知数种负调控机制能够调节NF-κB作用的持续时间。其中泛素化和蛋白酶体介导的与DNA结合的处于激活状态的NF-κB的降解,特别是它的RelA亚基的降解,是终止NF-κB转录作用的重要机制之一。这种降解是如何发生的一直悬而未决。该团队先前的研究发现,激活的NF-κB进入细胞核与DNA结合之后,组蛋白甲基转移酶Set9 会甲基化RelA亚基的K314和K315位点,引发RelA降解。然而,识别RelA甲基化信号的E3连接酶始终未被发现。
在本研究中,该团队通过筛选发现两个结构相似的CRL型E3连接酶复合物中的底物识别蛋白WSB1和WSB2可由它们的WDR结构域特异识别K314/315甲基化的RelA并促进其发生泛素化和降解,完成了“甲基化-泛素化-蛋白降解”这一NF-κB转录终止机制的拼图。该研究成果最近在线发表于本领域国际著名学术期刊《核酸研究》(Nucleic Acids Research )(JCR 1区,IF=14.9),论文题目为:WSB1/2 target chromatin-bound lysine-methylated RelA for proteasomal degradation and NF-κB termination.

RNA-seq和ChIP等功能研究表明,激活NF-κB的刺激会招募WSB1/2到NF-κB靶基因的启动子区域;敲低WSB1/2会造成与DNA结合的RelA的泛素化减少、蛋白水平增加和NF-κB靶基因表达的增强。在通过多种手段研究WSB1/2识别甲基化RelA的机制时我们发现,WSB1/2通过其N端WD-40重复(WDR)结构域与甲基化的K314/315特异性相互作用。利用最新的计算建模和模拟技术进一步分析发现,WSB1/2 WDR结构域中一个保守的天冬氨酸能与RelA的K314或K315形成配位键,当K314或K315发生甲基化时,两者的亲和力增强。实验验证结果显示突变该天冬氨酸位点会导致WSB2结合以及促进RelA泛素化的能力丧失。该研究揭示了WSB1/2在降解与DNA结合的甲基化RelA和阻止NF-κB持续激活方面的新功能,阐明了其中精细的分子机制,为NF-κB介导的炎症性疾病的干预提供了潜在的新靶点。
该研究工作获得了国家重点研发计划、上海市科技重大专项和国家自然科学基金等项目的支持。上海交通大学医学院张洁博士、我校2022级在读博士研究生余圆圆和上海交通大学医学院邹秀群博士为论文共同第一作者,杨晓东研究员为通讯作者,郑月娟教授、美国伊利诺伊大学香槟分校Lin-Feng Chen教授和上海交通大学医学院侯照远教授为共同通讯作者。四个实验室的多位研究生参与了该研究,美国伊利诺伊大学香槟分校Tajkhorshid教授团队进行了计算建模和模拟部分的研究,我校陈红专教授对研究工作给予了重要指导。
论文链接:https://academic.oup.com/nar/advance-article-abstract/doi/10.1093/ nar/g kae161/7624079?utm_source=advanceaccess&utm_campaign=nar&utm_medium=email