郑月娟、王海坤和章海兵团队发现调节性T细胞稳态维持的关键分子机制
调节性T细胞(Treg)是适应性免疫系统中专职负调控免疫应答的T细胞亚群,Treg细胞数量和功能的稳定性对抑制许多疾病,如自身免疫性疾病的发生至关重要。目前认为,T细胞受体(TCR)信号和IL-2细胞因子信号是维持Treg细胞稳态中的关键外源信号,其介导的胞内线粒体凋亡相关分子如Bim,Mcl-1,Bcl-2等发挥重要作用。然而,Treg细胞的稳态调控机制仍很不清楚。
国际著名学术期刊Cellular & Molecular Immunology(SCI 1区,IF=24.10)在线发表了上海中医药大学郑月娟课题组与同济大学附属东方医院王海坤课题组、中国科学院章海兵课题组合作的研究论文“RIPK1 Plays a Crucial Role in Maintaining Regulatory T Cell Homeostasis by Inhibiting both RIPK3 and FADD-Mediated Cell Death”,该研究发现受体相关蛋白激酶1(receptor-interacting protein kinase 1,RIPK1)在维持Treg细胞和常规CD4+ T细胞(Tconv)的稳态的机制不同,Treg细胞中RIPK1蛋白通过抑制FADD和RIPK3介导的凋亡和坏死促进Treg细胞的存活,而在常规CD4+ T细胞中,RIPK1主要通过抑制凋亡促进 CD4+ T细胞的存活。

TCR信号和IL-2细胞因子信号是维持Treg细胞稳态中的关键信号,研究团队发现RIPK1的表达主要受 TCR信号调控,TCR激活可显著上调RIPK1的表达,而RIPK1的表达不受IL-2信号调控。利用Treg细胞中特异敲除RIPK1的小鼠发现,缺失RIPK1的Treg细胞虽能在胸腺中正常发育成熟,并拥有正常的增殖能力,但在外周容易发生过度的细胞死亡,导致小鼠出现严重的致死性自身免疫性疾病。利用T细胞中同时敲除RIPK1和FADD,发现大部分常规CD4+ T细胞(Tconv)可以被挽救,而Treg细胞只能被部分挽救。进一步同时敲除RIPK1,FADD和RIPK3后,Treg细胞死亡可被完全挽救(Fig. 1)。通过系列的小鼠模型的建立和分析,该研究阐明了Treg细胞中RIPK1通过同时抑制凋亡和坏死,从而调控Treg细胞的稳态。该研究成果不仅加深了对T细胞稳态分子机制的认识,同时为靶向Treg细胞治疗炎症、自身免疫病、肿瘤提供了潜在重要靶标。
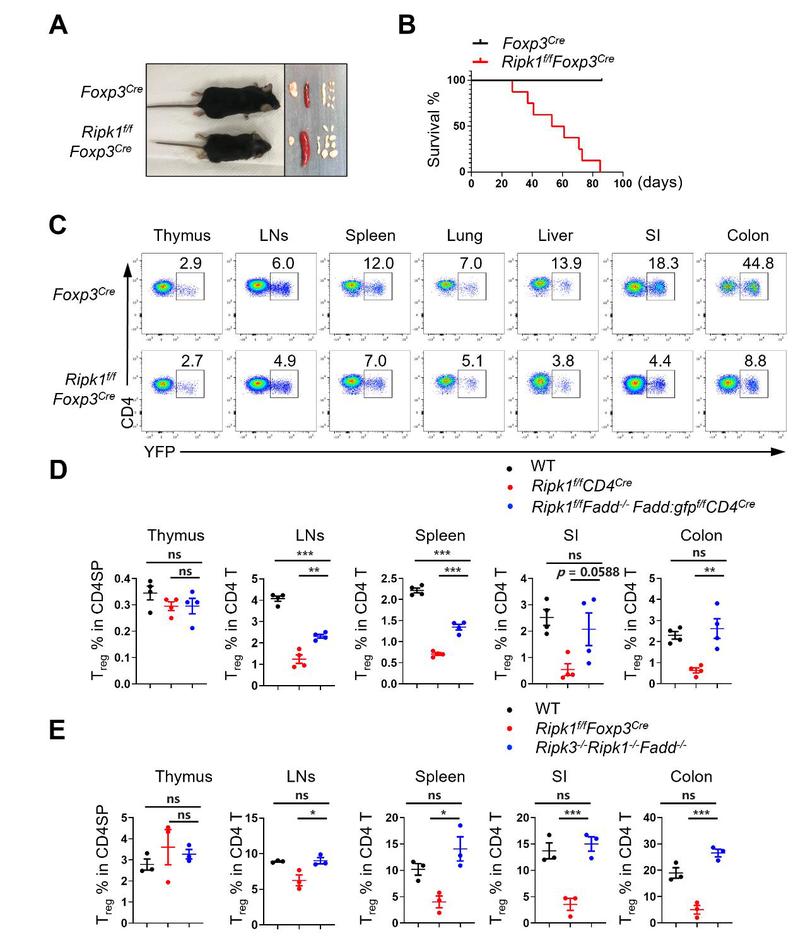
Figure 1. Treg细胞特异性敲除RIPK1导致致死性的系统性自身免疫反应
Treg细胞特异敲除RIPK1小鼠出现自身免疫性疾病
Treg细胞特异敲除RIPK1小鼠生存曲线
Treg细胞特异敲除RIPK1导致Treg细胞比例大幅降低
敲除FADD能部分挽救RIPK1敲除导致的Treg细胞死亡
同时敲除FADD和RIPK3能完全挽救RIPK1敲除导致的Treg细胞死亡
上海中医药大学郑月娟课题组和同济大学附属东方医院王海坤课题组(原中科院上海巴斯德研究所王海坤课题组)建立了长期合作关系,除了上述学术成果,在靶向Treg和Th17细胞的中医药单体的筛选、鉴定及机制研究也取得了重要进展,并联合培养了谢楠茜、陶艺文等多名研究生。